ANTIBIOGRAMA EN MUELLER HINTON
FUNDAMENTO
En esta práctica realizaremos una siembra en cesped, en placa con Mueller Hinton, para colocar distintos antibióticos y conocer qué antibiótico es el idóneo para inactivar la población.
OBJETIVO
El objetivo final de la práctica es identificar el antibiótico que va a ser capaz de inhibir el crecimiento bacteriano.
MATERIAL
Medios Mueller Hinton
Bacterias 2 y 9
SSF
Tubos de ensayo
Gradilla
Asa de siembra
Mechero bunsen
Asa de Digralsky
Vaso de precipitados
Alcohol
Pinzas
Antibióticos (Colistín, amoxicilina + Ac. clavulánico, Amikacin, Azlocillin)
Micropipeta de 100 microlitros
Puntas de micropipeta
COMPOSICIÓN MUELLER HINTON
PROCEDIMIENTO
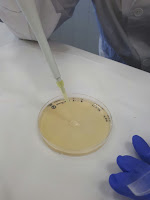
Echamos en un tubo de ensayo un poco de SSF. Cogemos el tubo con nuestra bacteria, esterilizamos el asa de platino, pasamos la boca del tubo por el mechero y cogemos un poco de muestra. Volvemos a pasar el tubo por el mechero, e introducimos el asa en el SSF, moviendolo de lado a lado para que se desprenda la muestra y se homogeinice. Vamos comparando con el patrón 0,5 de la escala McFarland, si nos falta turbidez, repetimos el procedimiento, si nos hemos pasado, añadimos SSF.
Rotulamos la placa de petri con la fecha y el número de muestra. Con la micropipeta, cogemos 100 microlitos de la suspensión y los depositamos en la placa. Mojamos el asa de Digralsky en alcohol y la llevamos el mechero para esterilizarla. Con ella vamos repartiendo la suspensión por toda la placa, para hacer una siembra en cesped.
Finalmente, elegimos los antibióticos que vamos a usar. Mojamos las pinzas en alcohol y las esterilizamos en el mechero. Cogemos el disco con el antibiótico y lo depositamos en la placa, todos los discos tienen que estar equidistantes. Apretamos un poco los discos con las pinzas para clavarlos en el agar.
Incubamos a 37º C durante 18 horas, y vemos cuál ha sido el antibiótico más eficaz.
RESULTADOS
Tras incubarlas, podemos comprobar como alrededor de algunos antibióticos no se ha producido crecimiento bacteriano. Por tanto, podemos concluir, según el diametro de los circulos donde no hay crecimiento, lo siguiente:
La bacteria número 2 presenta resistencia ante el antibiótico Azlocillin, sensibilidad media ante Colistín, y es sensible ante Amikacin y Amoxicilina con Ácido Clavulánico.
La bacteria número 9 presenta resistencia ante Azlocillin, Colistin y Amoxicilina con Ácido Clavulánico, y es sensible al Amikacin.
En esta práctica realizaremos una siembra en cesped, en placa con Mueller Hinton, para colocar distintos antibióticos y conocer qué antibiótico es el idóneo para inactivar la población.
OBJETIVO
El objetivo final de la práctica es identificar el antibiótico que va a ser capaz de inhibir el crecimiento bacteriano.
MATERIAL
Medios Mueller Hinton
Bacterias 2 y 9
SSF
Tubos de ensayo
Gradilla
Asa de siembra
Mechero bunsen
Asa de Digralsky
Vaso de precipitados
Alcohol
Pinzas
Antibióticos (Colistín, amoxicilina + Ac. clavulánico, Amikacin, Azlocillin)
Micropipeta de 100 microlitros
Puntas de micropipeta
COMPOSICIÓN MUELLER HINTON
1,5 g/l de Almidón
2 g/l de infusión de carne
17,5g/l de peptona de caseína hidrolizada
17g/l de agar
pH: 7,4
Echamos en un tubo de ensayo un poco de SSF. Cogemos el tubo con nuestra bacteria, esterilizamos el asa de platino, pasamos la boca del tubo por el mechero y cogemos un poco de muestra. Volvemos a pasar el tubo por el mechero, e introducimos el asa en el SSF, moviendolo de lado a lado para que se desprenda la muestra y se homogeinice. Vamos comparando con el patrón 0,5 de la escala McFarland, si nos falta turbidez, repetimos el procedimiento, si nos hemos pasado, añadimos SSF.
Rotulamos la placa de petri con la fecha y el número de muestra. Con la micropipeta, cogemos 100 microlitos de la suspensión y los depositamos en la placa. Mojamos el asa de Digralsky en alcohol y la llevamos el mechero para esterilizarla. Con ella vamos repartiendo la suspensión por toda la placa, para hacer una siembra en cesped.
Finalmente, elegimos los antibióticos que vamos a usar. Mojamos las pinzas en alcohol y las esterilizamos en el mechero. Cogemos el disco con el antibiótico y lo depositamos en la placa, todos los discos tienen que estar equidistantes. Apretamos un poco los discos con las pinzas para clavarlos en el agar.
Incubamos a 37º C durante 18 horas, y vemos cuál ha sido el antibiótico más eficaz.
RESULTADOS
Tras incubarlas, podemos comprobar como alrededor de algunos antibióticos no se ha producido crecimiento bacteriano. Por tanto, podemos concluir, según el diametro de los circulos donde no hay crecimiento, lo siguiente:
La bacteria número 2 presenta resistencia ante el antibiótico Azlocillin, sensibilidad media ante Colistín, y es sensible ante Amikacin y Amoxicilina con Ácido Clavulánico.
La bacteria número 9 presenta resistencia ante Azlocillin, Colistin y Amoxicilina con Ácido Clavulánico, y es sensible al Amikacin.
Bacteria 9 Bacteria 2










buen post, saludos desde Mexico!!
ResponderEliminar